Chimie
| Dëse Chimiesartikel ass eréischt just eng Skizz. Wann Dir méi iwwer dëst Theema wësst, sidd Dir häerzlech invitéiert, aus dëse puer Sätz e richtegen Artikel ze schreiwen. Wann Dir beim Schreiwen Hëllef braucht, da luusst bis an d'FAQ eran. |
D'Chimie (v. griich. χημεία, chimía) ass eng vun den Naturwëssenschaften. Et ass d'Léier vum Opbau, Verhalen an der Ëmwandlung vun der Matière an hire Verbindungen, wéi och de Gesetzméissegkeeten, déi dobäi gëllen.
Si ass an hirer haiteger Form am 17. an 18. Joerhonnert lues a lues entstanen, wéi versicht gouf, d'Beobachtungen an d'Experimenter vun der Alchimie op eng reng rational Aart a Weis ze verstoen.
Wat ass d'Chimie?
ännerenChimie ass déi wëssenschaftlech Richtung déi sech ëm d'Matière an all hiren Zoustänn këmmert an och ëm Transformatioune vun der Matière. Dat heescht, d'Chimie ënnersicht Gasen, Flëssegkeeten a Festkierperen a kuckt méi genee wéi déi eenzel Substanze matenee reagéieren. Dobäi kann een tëscht organescher Chimie, mineralerescher Chimie, anorganescher Chimie, Biochimie, medezinescher Chimie, katalytescher Chimie, analytescher Chimie,... ënnerscheeden. Déi eenzel Chimierichtunge hu vill Iwwerschneidungen.
D'Chimie këmmert sech haaptsächlech ëm déi Elektronen déi am leschten eidelen Elektronenorbital (LUMO, lowest unoccupied molecular orbital) an am éischte vollen Elektronenorbital (HOMO, highest occupied molecular orbital) sinn.
D'Chimie ënnersicht och d'Bindungen tëscht den eenzelen Elementer. Et gëtt verschidde cheemesch Bindungen.
Geschicht vun der Chimie
ännerenD'Virgängerin vun der Chimie ass d'Alchimie. Déi Pseudowëssenschaft verbënnt verschidde Gebidder wéi Astrologie, Philosophie an Esoterik. Obwuel d'Resultater vun der Alchimie wëssenschaftlech onbedeitend a souguer dacks absolut falsch waren, hu s'awer den éischte Schrëtt zu enger exakter Wëssenschaft duergestallt.
Eng vun de wichtegsten Entwécklunge war déi vun der Valenztheorie. Déi ass fir d'éischt als Konzept vum Edward Frankland am Joer 1852 virgestallt ginn. Si ass haaptsächlech duerch Experimentalcheemiker entwéckelt a weiderentwéckelt ginn. Do kann ee besonnesch d'Aarbechte vum Friedrich August Kekulé, Adolph Wilhelm Hermann Kolbe, Archibald Scott Couper a vum Aleksandr Mikhailovich Butlerov ervirhiewen.
Ee weidere wichtegen Deel vun der Chimie, nämlech Stereochimie, dat heescht: wéi d'Moleküllen am Raum orientéiert sinn, ass och am 19. Joerhonnert entwéckelt ginn. Dat ass de brillante Postulat vun der tetrahedral Orientatioun, dee vun de Cheemiker Jacobus Henricus van't Hoff a Joseph Achille le Bel (1874), awer och déi geneesou erstaunlech Resultater vum Alfred Werner an der anorganescher Stereochimie.
Dës Cheemiker hate keng modern Analysmëttele wéi X-Stralen, Magnetesch Nuklear Resonnanz, Infrarout, Raman Spectroscopie, Microwelle Spectroscopie,...
Am 19. Joerhonnert ass d'Bindung duerch ee Stréch symboliséiert ginn ouni eng spezifesch Bedeitung, well d'Elektrone waren nach net entdeckt. No där Entdeckung goufe reieweis Theorien entwéckelt fir d'Elektronen z'erklären an de Stréch zwëscht den Elementer huet eng Bedeitung krut. Hei kann een dem Gilbert Newton Lewis seng Aarbecht ernimmen, déi 1916 verëffentlecht gouf an deem seng Symbolik nach bis haut gëlteg ass. Z'ernimmen ass dann awer och de W. Kosel, deen zur selwechter Zäit eng änlech Aarbecht verëffentlecht huet. Virun dësen Zwéin hunn de W. Ramasay, den J.J. Tomson, den J. Stark an den A. L. Parson ënner anerem un dem Elektron geschafft. Dem Lewis seng Aarbecht gëtt dacks als "Théorie de l'octet" bezeechent a gouf vum I. Langmuir nach verdéift.
Bedeitung vun der Chimie
ännerenChimie gehéiert haut zu de wichtegste Wëssenschaften. Si ass net nëmmen aktiv fir nei Substanzen z'entwéckelen, an domat zum Beispill Medikamenter géint Krankheeten ze maachen, mä si entwéckelt och nei Materialien déi mir am Alldag gebrauche wéi zum Beispill Teflon. Mä d'Chimie ass och déi Wëssenschaft déi dofir zoustänneg ass ons Liewensmëttel ze kontrolléieren. Si erfëllt also eng Eegekontroll an dem se net nëmme Liewensmëttelcheemikalien entwéckelt, si verfollegt och op déi schiedlech sinn an duerno kuckt Chimie och op déi Substanzen net ze vill benotzt ginn.
Am Wëssenschaftsbam fëllt se d'Plaz tëscht der Physik an der Biologie. Si behandelt vun den äusseren Elektronenorbitalen, am Beräich vun der theoreetescher Chimie, bis zum Zesummespill vun de Moleküllen an den Enzymen, Zellwänn, etc. an der supramolekularer Chimie. Fir all déi eenzel Aufgaben hu sech ëmmer erëm nei Ënnerdeelungen, déi awer enk zesummeschaffen, entwéckelt.
Fachrichtungen
änneren- Anorganesch Chimie
- Organometallesch Chimie
- Organesch Chimie
- Physikalesch Chimie
- Makromolekular Chimie
- Technesch Chimie
- Analytesch Chimie
- Spektroskopesch Methoden: NMR / IR / Raman / UV-VIS / Massespektrum...
- Trennungsmethoden: Gaschromatographie/HPLC
- Biochimie
- Liewensmëttelchimie
Cheemesch Grondbegrëffer
ännerenAtom
ännerenD'Atomer sinn d'Bausteng vun der Matière. Si bestinn aus engem Atomkär an engem Elektronemantel. Den Atomkär setzt sech zesummen aus Protonen an Neutronen. D'cheemesch Natur vun engem Element gëtt definéiert duerch d'Zuel vun de Protonen a sengem Kär. D'Protone sinn eefach positiv gelueden a stousse sech géigesäiteg of. D'Neutrone verhënneren, datt de Kär spontan auserneebrécht. Fir datt en Atom makroskopesch gesinn neutral ass, mussen am Elektronemantel geneesou vill Elektrone sinn, wéi Protonen am Kär. De geneeën Opbau vun engem Atom gëtt duerch d'Quantemechanik beschriwwen. Wann en Atom méi wéi een Elektron a sengem Mantel huet, da beweege sech d'Elektronen a ganz genee definéierten Orbitalen, woubäi all Orbital e ganz bestëmmten Energieniveau (dowéinst den Ausdrock Quanten- mechanik)) huet. D'Elektrone kënnen zwëscht den Energieniveauen hin an hier sprange woubäi si entweeder Energie vu bausse musse kréien, oder awer Energie kënne fräisetzen, z. B. als Photon (Liichtquant).
En Elektron huet quasi kee Gewiicht, d'Gewiicht vum Atom, an domat vun der ganzer Matière, gëtt vum Kär gedroen.
Element
ännerenWann eng bestëmmt Matière net méi a verschidden Atomer, (mat verschiddenen Zuele vu Protonen am Kär), opgespleckt ka ginn, da schwätzt ee vun engem cheemeschen Element. En Element ka bei Zëmmertemperatur an normalem Drock an dräi Aggregatszoustänn optrieden: flësseg (z. B. Quecksëlwer), fest (z. B. Gold) a gasfërmeg (z. B. Argon). Et ka sinn, datt verschidden Atomer ënnerschiddlech Zuele vun Neutronen hunn, mä déi selwecht Zuel vu Protonen. An deem Fall schwätzt ee vun Isotopen: 12C an 13C. Déi Atomer gehéieren dann ëmmer nach zum selwechten Element, mä hu verschidde Gewiichter. En Element huet ëmmer déi selwecht cheemesch Eegenschaften, mä déi physikalesch hänke vum Gewiicht of.
All Element huet ee Symbol (mat maximal zwéi Buschtawen) an dat ass an all Sprooch d'selwecht.
Méi Informatioun doriwwer am Artikel: Element (Chimie).
Moleküllen
ännerenMolekülle si gebonnen Usammlunge vun Atomer.
Ion
ännerenIone sinn negativ oder positiv gelueden Deelecher, also Atomer oder Moleküllen. Et kann een ënnerscheeden zwëscht Kationen (positiv gelueden Deelecher) an Anionen (negativ gelueden Deelecher).
Bindung
ännerenAn engem Moleküll sinn d'Atomer duerch cheemesch Bindunge verbonnen. D'Aart a Weis wéi se verbonne sinn, gëtt duerch d'Quantemechanik beschriwwen. Et gi follgend Typpe vu Bindungen ënnerscheet:
a) Kovalent Bindung,
b) Ionesch Bindung,
Bei enger kovalenter cheemescher Bindung ginn Elektrone vun zwéin Atomer gedeelt, wouduerch sech déi betreffend Elektronenorbitaler iwwerlappen. Doduerch erreeche si déi optimal Zuel vun Elektronen am baussenzegen Elektronenorbital. Wann zwéin Elektrone gebraucht ginn, schwätzt ee vun enger Einfachbindung, bei véier oder sechs Elektrone vun enger Duebelbindung, respektiv vun enger Dräifachbindung. Déi Zorte vu cheemescher Bindung (Einfach-, Duebel- an Dräifachbindung) nennt een allgemeng kovalent Bindung.
Eng Bindung kann och ouni Iwwerlappung vun Elektronenorbitaler geschéien, z. B. duerch ënnerschiddlech lokal Luedungen, positiv bei deem engen an negativ bei deem anere Moleküll. Well dobäi ganz dacks Waasserstoff am Spill ass, nennt een déi Bindungen och Waasserstoffbindungen. Si sinn allerdéngs méi schwaach wéi kovalent cheemesch Bindungen.
Bei der ionescher Bindung gëtt een Austausch vun Elektrone gemaach. Meeschtens gëtt ee Metallatom, Bsp. Na Natriumatom een Elektron un Net-Metall wei z. B. Cl Chloratom of. De Metall ass da positiv gelueden Na - e- --> Na+ an den Net-Metal negativ Cl + e- --> Cl-. Déi positiv an negativ gelueden Atomer nennt een och Ionen. Déi Ione bilden da Kristaller mat enger bestëmmter Form, déi sech ëmmer erëm am Raum widderhëlt. De Kristall huet eng Formel déi dat statistescht Verhältnes vun de Ionen erëmgëtt, Bsp: NaCl Kachsalz.
Bei der metallescher Bindung ginn all Valenzelektronen zwëscht alle Metallatomer gedeelt. Dat Ganzt gëtt dacks mat engem Elektronegas verglach. Déi Mobilitéit vun den Elektronen erkläert och wéisou d'Metaller de Stroum gutt leeden.
Mat de van der Waals Bindunge sinn all Dipol Bindunge gemengt.
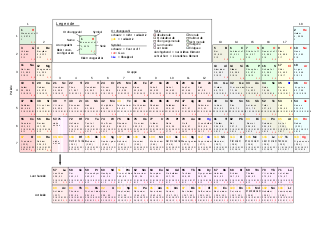
Periodesystem vun den Elementer
änneren Méi Informatioun doriwwer am Artikel: Periodesystem vun den Elementer.
Bekannt Cheemiker
ännerenE puer vun deenen éischte grousse Cheemiker waren de Kurt Alder, de Richard Anschütz, de Henry Edward Armstrong, de Svante August Arrhenius, de Francis William Aston, den Amedeo Avogadro, de Francis Bacon, de Leo Hendrik Baekeland, den Adolf Johann Friedrich Baeyer, den Alexei Alexandrowitsch Balandin, den Antoine Jérôme Balard, den Eugen Bamberger, de Philippe Antoine Barbier, de Sir Derek Harold Richard Barton, de Valentin Basilie, den Antoine Baumé, de Johann Joachim Becher, den Ernst Otto Beckmann, den Antoine César Becquerel, den Henri Antoine Becquerel, de Friedrich Konrad Beilstein, de Friedrich Bergius, de Toborn Olof Bergman, de Claude Louis Berthollet, de Niels Janniksen Bjerrum, de Joseph Black, den Hermann Boerhaave, den Niels Henrik David Bohr, den Alexandre Porphyrievitch Borodine, de Carl Bosch, de Robert Boyle, de Jöns Jacob Berzelius,de Marcelin Pierre Eugène Berthelot, den Henri Braconnot, de Johannes Nicolaus Brönsted, den Herbet Charles Brown, den Eduard Büchner, de Robert Wilhelm Bunsen, den Adolf Friedrich Johann Butenandt, den Alexandre Mikhaïlovitch Butlerov, de Jean-Baptiste Dumas, den Henri Etienne Sainte-Claire Deville, de Joseph Louis Gay-Lussac, d'Marie an den Antoine Lavoisier an de Justus von Liebig. Mä och den John Osborne oder de Jean-Marie Lehn hunn an de leschte Joerzéngten zur Weiderentwécklung vun der Chimie bäigedroen.
Kuckt och
ännerenUm Spaweck
änneren| Commons: Chimie – Biller, Videoen oder Audiodateien |